当前位置>网站首页 > 医疗器械/防疫物资服务 > 欧洲法规
 |
按照欧盟医疗器械相关法规要求,国外生产商出口产品到欧盟境内,需要欧盟授权代表为其申请欧盟注册号,可在欧盟各成员国医疗器械主管机构办理。
欧盟授权代表应履行的职责:
1)欧盟境外的制造商委任一个设立于(established in)欧盟+EFTA共30个成员国境内的欧盟授权代表/欧盟代表(欧盟授权代理) (Authorized Representative),专门代表欧盟境外的制造商与欧洲30国的政府和机构打交道。
2)从欧盟境外进口的加贴CE标志的产品的包装、标签和使用说明书等上面,必须清楚地印上制造商 的欧盟授权代表/欧盟代表(欧盟授权代理)的名称、地址。
3)“技术文件”必须保存于欧盟授权代表/欧盟代表(欧盟授权代理)处,欧盟授权代表/欧盟代表(欧盟授权代理)处必须保存最新的、所有加贴CE标志的产品的“技术文件”(TechnicalFiles)。 根据欧盟法律,确保能随时及时地提供给欧盟境内CE监督机关检核。 在最后一批产品投入市场之后,其技术文件应在欧盟授权代表/欧盟代表(欧盟授权代理)处保留至少5年。
4)建立“事故防范监督系统”,欧盟境外的制造商必须在欧盟境内建立一套有效的“事故防范监督系统”,通过其欧盟授权代表/欧盟代表(欧盟授权代理) 对产品的事故报告、通告、召回等等提供协助。
5)欧盟授权代表还可以应制造商的委托为其进行欧盟主管当局的器械注册申请。
6)欧盟授权代表还可以应制造商的委托为其申请自由销售证明。
需要的资料:
申请者公司信息
产品信息
产品说明书(如必要)
符合性声明(DOC)
……
办理周期:
受疫情影响,注册完成所需时间大幅增加,各国进程不一。
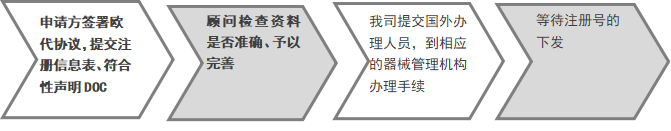
办理流程示例(I类低风险):
为什么选择我们?
国内认证、国际认证均可,企业无需多家机构联系。
专注卫生与健康领域,高效、精准的服务,助您快速拿到证书。
顾问均知名机构十年以上工作经历,资历深厚,资源广泛。
定制化服务,与企业规模、水平相适宜,避免企业走弯路。
深耕该领域十余年,良好的信誉。
更多产品的注册流程,欢迎拨打热线 400 998 0907